(Este artículo rescata un escrito de Forbes de 1894 en el libro abajo referenciado)
LOS AULLADORES. SUBFAMILIA MYCETINÆ
(actual: Subfamilia Alouattinae, género Alouatta)
Autor original: Henry O. Forbes (1894)
Esta subfamilia abarca solo un género, que es muy distinto de todos los demás. Los Aulladores son los más grandes de los monos sudamericanos, y se caracterizan por su cuerpo grueso y torpe, su cabeza piramidal y su pequeño ángulo facial, debido a su largo hocico, algo parecido al de un perro. El ángulo de la mandíbula inferior es muy grande y macizo, y su característica principal es el engrosamiento notable de la garganta, debido al gran aumento de los huesos hioides —que están ampliamente inflados y cavernosos— para formar el curioso órgano vocal que poseen los machos de estos animales, y mediante el cual su voz puede ser tan aumentada como para escucharse a varios kilómetros de distancia. (Actual: aparato hioideo extremadamente expandido en los machos del género Alouatta). El cráneo está truncado por detrás en el macho (menos en la hembra) para la recepción del aparato vocal. Sus incisivos son pequeños e iguales, los caninos son prominentes y tienen una cresta oblicua a través de la corona desde la cúspide externa anterior hacia la interna posterior, y los molares superiores son grandes. La cola es fuerte y prensil, desnuda hacia la punta, donde es táctil y muy sensible. El pulgar es móvil, la cara desnuda, y la barbilla con barba. Algunos tienen pelaje corto y otros largo sobre sus cuerpos, pero generalmente es más abundante alrededor de la cabeza. En apariencia son los más poco atractivos y repulsivos de los monos americanos. Su inteligencia también es de un orden muy bajo.
(Actual: apreciación histórica subjetiva; no es aceptada hoy como evaluación científica).
El techo de la caja craneana está deprimido; el plano de la apertura para el paso de la médula espinal desde el cerebro es casi perpendicular al de la base del cráneo; los cóndilos para la articulación del cuello están situados lo más atrás posible. Sir William Flower, en su valiosa monografía sobre el cerebro de Mycetes (= Alouatta), ha mostrado que los lóbulos frontales son pequeños y que los hemisferios cerebrales apenas cubren el cerebelo. En lo que respecta a sus surcos y circunvoluciones, el cerebro principal (cerebrum) de Mycetes puede distinguirse del de todos los demás monos. Todo el órgano es pequeño en comparación con el tamaño del animal; carece de la redondez y plenitud del de los monos araña (Ateles) y de los capuchinos (Cebus). Sus marcas superficiales son comparativamente pocas y simples, y se apartan notablemente del tipo ordinario visto en el orden.
Entre los monos del Viejo Mundo hay una similitud notable en el carácter de las marcas superficiales de sus hemisferios cerebrales. Hay un ligero desarrollo ascendente desde Cercopithecus hacia Hylobates; y mayores complicaciones superpuestas al mismo tipo primitivo —como gran tamaño proporcional y complejidad de las circunvoluciones— se observan en el chimpancé y el gorila, conduciendo hacia el cerebro del hombre. Entre los géneros del Nuevo Mundo hay una divergencia mucho mayor. Entre los capuchinos (Cebus), y solo entre ellos, hay una repetición precisa del tipo del Viejo Mundo; pero en el género Mycetes (= Alouatta), encontramos modificaciones para las cuales no existe paralelo entre la serie catarrina. Hay una ausencia en su cerebro de signos de elevación en serie; y exhibe una gran diferencia con todos, incluso los más bajos de las formas del Viejo Mundo, así como con aquellos monos americanos que, en carácter cerebral, se asemejan de cerca a los monos del Viejo Mundo. Muestra afinidad en algunos de sus rasgos más llamativos con formas bajas de monos del Nuevo Mundo como Nyctipithecus (= Aotus). El tipo cerebral bajo concuerda, como observa Sir William Flower, con su disposición hosca y no domesticable, y con la observación de que su inteligencia es de un orden muy diferente al de sus vecinos, los monos araña y capuchinos.
“Cuando se ven Aulladores en el bosque”, señala el Sr. Bates, “generalmente hay tres o cuatro de ellos montados en las ramas superiores de un árbol. No parece que su estremecedor rugido sea emitido por un susto repentino; al menos, no fue así en individuos cautivos. Es probable, sin embargo, que el ruido sirva para intimidar a sus enemigos.” El poder muscular empleado para dar salida a su rugido cavernoso parece pequeño. Su alimento consiste principalmente en frutos y hojas.
En color, los Aulladores varían mucho. Las crías de ambos sexos a menudo difieren de sus padres, y las hembras de los machos, y también hay gran variación individual.
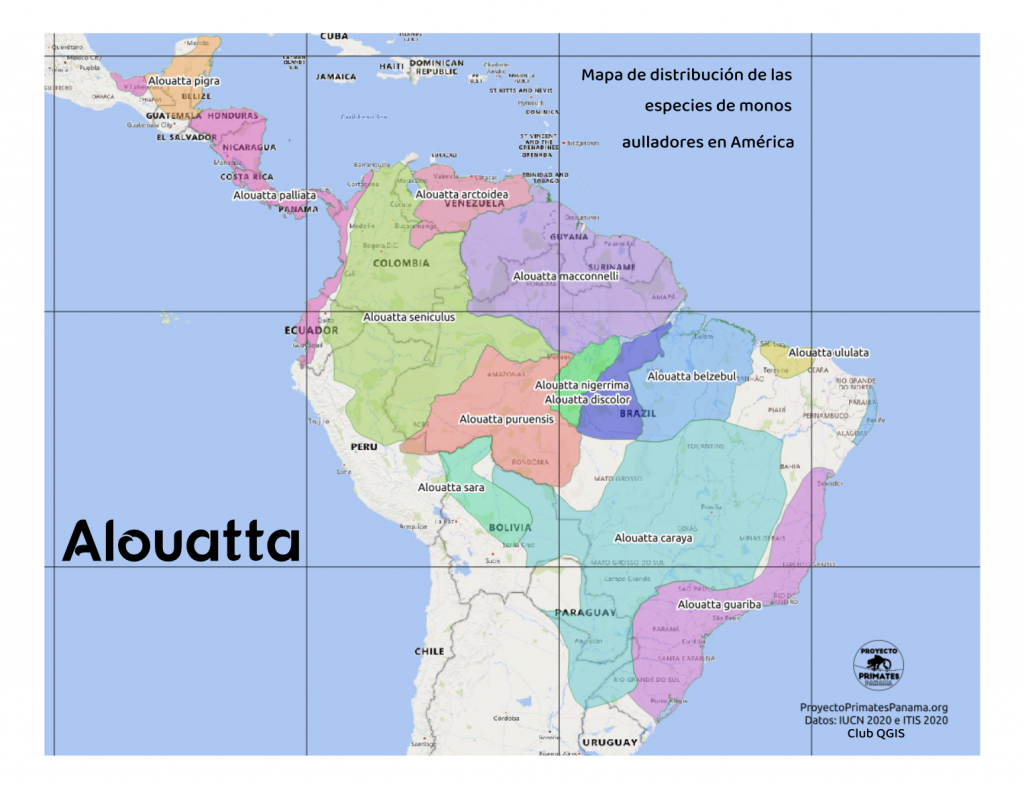
La distribución geográfica de algunas especies es muy restringida, varias de ellas estando confinadas a un distrito especial del Amazonas, en el cual ninguna otra especie se introduce. Se encuentran, sin embargo, desde el este de Guatemala hasta Paraguay.
LOS AULLADORES. GÉNERO ALOUATTA
Alouatta, Lacép., Mém. Inst., iii., p. 490 (1801).
Mycetes, Illig., Prodr. Syst. Mamm., p. 70 (1811) (sinónimo).
Stentor, Geoffr., Ann. Mus., xix., p. 107 (1812) (sinónimo).
Los caracteres del género Mycetes (= Alouatta), que es el único de la subfamilia, son los mismos que los dados arriba.
El género contiene seis especies bien reconocidas. Según el Sr. Wallace, las especies roja y negra del Amazonas tienen hembras del mismo color que los machos. Humboldt también observa, hablando de los miles de Arguatoes (M. seniculus = Alouatta seniculus) que vio en las provincias de Cumaná, Caracas y Guayana, que nunca observó cambio en el pelaje rojizo del dorso y hombros. Muchas especies, sin embargo, muestran dimorfismo de coloración.
Los Aulladores son semi-nocturnos en sus hábitos, emitiendo sus gritos tarde en la tarde y antes del amanecer, y también cuando se aproxima la lluvia.
Cuando un Mycetes es disparado, permanece colgando del árbol aunque esté muerto, hasta que sus músculos se relajan.
Las especies del género se distribuyen por Centroamérica, Colombia, la región amazónica, hasta el sur de Brasil, Bolivia y Paraguay.
I. EL AULLADOR ROJO — ALOUATTA SENICULUS
(Simia seniculus, Stentor ursina, Mycetes seniculus, etc. → Alouatta seniculus, nombre válido actual)
Caracteres.—Cabeza, cuello, extremidades y cola castaño oscuro; dorso y flancos dorado-amarillos; barba del macho adulta larga, amarilla en la raíz y castaña por fuera; cara desnuda y negra; pecho desnudo; abdomen con pelos largos y castaños.
Pelo suave. Cola variable en color; a veces del color del dorso y otras dorado brillante. Mamas a veces axilares. Cuerpo 19½ pulgadas; cola 20.
Jóvenes.—Del mismo color, algo más oscuros; pelo duro.
Distribución.—Brasil; Nueva Granada (Colombia); Venezuela; río Copataza (Ecuador); este del Perú, ríos Ucayali y Huallaga.
Hábitos.—Viajan en grandes tropas. Humboldt describe procesiones de 30–40 individuos moviéndose lentamente, con hembras cargando crías. Rechaza el mito de que formen cadenas para cruzar ríos. Declara que las caídas de crías son accidentales. Wallace indica que el fuerte grito suele provenir de un solo macho. La carne es apreciada como alimento.
II. EL AULLADOR NEGRO — ALOUATTA NIGRA
(Stentor caraya, Mycetes barbatus, Mycetes niger, etc. → Alouatta caraya, nombre válido actual)
Macho.—Pelo largo y completamente negro; cresta frontal marcada. Longitud 20 pulgadas; cola 17.
Hembra y jóvenes.—Pajizos, oscureciéndose con la madurez; el macho adulto se vuelve negro.
Ejemplares intermedios coinciden con descripciones antiguas de Humboldt.
Distribución.—Sur de Brasil, Paraguay, Bolivia; registros aislados en el Madeira.
Hábitos.—Huraños; en cautiverio se ocultan; los indígenas no logran domesticarlos; rara vez sobreviven largo tiempo.
III. EL AULLADOR DE MANOS AMARILLAS — ALOUATTA BEELZEBUL
(Actual: Alouatta belzebul)
Negro, con tintes amarillos en partes inferiores; raíces del pelo pardas; manos y pies variables (amarillo-rojizos, pardos, grises o negros). Marcas amarillas en cola, orejas y rodillas. Cuerpo 17½ pulgadas; cola 18½.
Distribución.—Bajo Amazonas, cerca de Pará.
Hábitos.—Como las demás especies.
IV. EL AULLADOR PARDO — ALOUATTA URSINA
(Stentor ursina, Mycetes fuscus, Mycetes bicolor, etc. → Complejo Alouatta guariba/discolor)
Color amarillo-rojizo brillante o pardo amarillento; pelos rígidos, negros con puntas amarillas; hombros anillados. Semiadultos casi negros. Cola más corta que el cuerpo, negro-oliva con franjas amarillas.
Jóvenes.—Negros, con puntas amarillas; base de cola rojiza.
Distribución.—Río Negro y Alta Amazonía.
V. EL AULLADOR GUATEMALTECO — ALOUATTA VILLOSA
(Mycetes villosus = Alouatta pigra, nombre válido actual)
Se distingue de A. caraya por pelaje más largo y suave, con tonos rojizos en la base; pelos frontales a veces dirigidos hacia abajo; mejillas pardas.
Macho.—Negro entero.
Hembra y jóvenes.—También negros, no pajizos como en A. caraya.
Distribución.—Guatemala oriental y nororiental; bosques de Izabal, Polochic, Verapaz y Petén; de 700 a 3.000 pies; muy abundante.
Incluye larga descripción de Salvin sobre su abundancia, su uso como alimento por indígenas, su presencia incluso a 6.000 pies, y la obtención de especímenes para el Museo Británico.
Hábitos.—Grupos de 5–6; se desplazan lentamente en ramas altas; aullido audible a 2 millas, y hasta una legua sobre el lago de Izabal.
Incluye relato histórico de Dampier sobre comportamientos agresivos aparentes, uso de la cola, carga múltiple de crías y dificultad de domesticación.
VI. EL AULLADOR ENCAPOTADO — ALOUATTA PALLIATA
(Nombre aceptado actual: Alouatta palliata)
Cara desnuda; pelo frontal corto y vuelto hacia atrás formando cresta; dorso pardo-negruzco con flancos pardo-amarillos extendidos en forma de manto; extremidades y cola negras. Longitud 19½ pulgadas; cola 20¾.
Gran variación individual en intensidad del color, tanto en Costa Rica, Nicaragua como en Panamá. La variación no depende de la localidad.
Distribución.—Lago de Nicaragua; Costa Rica; Panamá; islote Hicaron en Quibo. Al sur del istmo es reemplazado por A. seniculus.
Hábitos.—Prefiere las ramas altas; no daña plantaciones; temperamento apacible y melancólico; algo más adaptable al cautiverio que otras especies; un macho domesticado aullaba antes de la lluvia y diariamente a las 5 a.m.
LOS AULLADORES (Subfamilia Alouattinae)
Síntesis moderna basada en evidencia científica actual (2025)
Los monos aulladores (género Alouatta) constituyen uno de los linajes más ampliamente distribuidos y exitosos entre los primates neotropicales. Se encuentran desde el sureste de México hasta el norte de Argentina, ocupando selvas húmedas, bosques secos, bosques de galería y mosaicos antropizados con distintos grados de conservación.
Se reconocen entre 13 y 15 taxones según el enfoque taxonómico, aunque la tendencia actual es a validar las siguientes especies principales:
Especies actualmente reconocidas (2025)
| Región | Especie válida | Comentarios taxonómicos |
|---|---|---|
| Mesoamérica | Alouatta palliata | Varias subespecies; presente en Costa Rica y Panamá. |
| Guatemala–Belice | Alouatta pigra | Especie grande, negra; previamente llamada A. villosa. |
| Colombia–Venezuela–Brasil amazónico | Alouatta seniculus (complejo) | Múltiples linajes; diversidad aún en revisión. |
| Sur de Brasil–Paraguay–Bolivia | Alouatta caraya | Dimorfismo sexual marcado (machos negros, hembras doradas). |
| Amazonia oriental (Pará–Maranhão) | Alouatta belzebul | Pelaje negro con extremidades rojizas variables. |
| Bosques atlánticos del sureste de Brasil | Alouatta guariba / A. discolor | La separación entre ambas depende del enfoque molecular. |
Rasgos anatómicos clave
1. Aparato hioideo altamente especializado
El rasgo más distintivo del género es el hueso hioides hipertrofiado, especialmente en los machos. Esta estructura se desarrolla como una cavidad resonante capaz de amplificar el llamado territorial a distancias que pueden superar los 3 km bajo condiciones adecuadas.
Este rasgo se considera una innovación evolutiva única entre los primates, relacionada con:
-
la defensa acústica del territorio,
-
la minimización del contacto físico entre tropas,
-
la vida en bosques densos donde la visibilidad es limitada.
2. Dentición y dieta folívora
Comparados con otros primates del Nuevo Mundo, los aulladores poseen:
-
molares relativamente grandes,
-
crestas bien desarrolladas para triturar hojas,
-
incisivos pequeños.
Son folívoros generalistas, consumiendo hojas jóvenes, flores, brotes y frutos estacionales. Esta dieta permite una vida de bajo gasto energético.
3. Cola prensil táctil
Todos los miembros del género presentan una cola prensil desnuda en la punta, con una almohadilla dérmica rica en mecanorreceptores. Funciona como un quinto miembro, especialmente útil para individuos juveniles y hembras con crías.
4. Neuroanatomía
Las descripciones del siglo XIX hablaban de un “cerebro simple” o “baja inteligencia”. La primatología moderna rechaza este lenguaje. Hoy se entiende que:
-
el cerebro de Alouatta está adaptado a un estilo de vida folívoro,
-
la socioecología del grupo no requiere la complejidad observada en Cebus o Ateles,
-
la cognición se orienta a memoria espacial, selección dietaria y comunicación acústica, no a manipulación avanzada.
Comportamiento y ecología
Estructura social
Los grupos suelen estar compuestos por 5–15 individuos, con un sistema flexible que puede incluir varios machos y varias hembras. La cohesión de grupo es relativamente alta.
Territorialidad acústica
Los aulladores son conocidos por sus vocalizaciones profundas, que cumplen funciones de:
-
evitar encuentros costosos entre tropas,
-
anunciar la ocupación de un espacio,
-
sincronizar actividades del grupo.
El llamado se realiza al amanecer, atardecer o antes de lluvias intensas.
Actividad diaria
Son primates de bajo gasto energético:
-
descansan gran parte del día,
-
se desplazan poco comparados con Ateles o Cebus,
-
emplean estrategias de termorregulación conductual (sun basking, selección de ramas altas).
Reproducción
Las crías dependen estrechamente de la madre, que suele cargar una sola cría por ciclo reproductivo. En especies como A. pigra es común el infanticidio en reestructuraciones sociales.
Distribución moderna por especie
1. Alouatta seniculus — Aullador rojo amazónico
Amplia distribución en la cuenca amazónica. Exhibe la mayor variación cromática del género. Estudios recientes sugieren que es un complejo de especies en proceso de revisión taxonómica.
2. Alouatta caraya — Aullador negro o carayá
Propio del Cono Sur tropical. Marcado dimorfismo sexual:
-
machos: negros;
-
hembras: amarillas o pajizas.
Se adapta a ambientes más abiertos.
3. Alouatta belzebul — Aullador del este amazónico
Coloración negra con manos y pies rojizos. Distribución fragmentada debido a la pérdida de bosque en la Amazonia oriental.
4. Alouatta guariba y A. discolor — Aulladores del Bosque Atlántico
Las poblaciones del sureste brasileño presentan variación geográfica compleja. La conservación es crítica debido a la deforestación extrema del bioma.
5. Alouatta pigra — Aullador de Guatemala y Belice
Especie grande, de pelaje negro uniforme.
Distribución moderna:
-
Belice
-
norte de Guatemala
-
oeste de Honduras
-
sur de México (Tabasco, Campeche, Quintana Roo)
Está clasificado como En Peligro (EN).
6. Alouatta palliata — Aullador de manto
Distribuido desde el sureste de México hasta el oeste de Colombia. En Panamá es la especie más ampliamente distribuida del género.
Subespecies reconocidas (según enfoque 2025):
-
A. p. palliata (Panamá occidental, Costa Rica, Nicaragua)
-
A. p. aequatorialis (Panamá oriental – Darién, Colombia, Ecuador)
Especie altamente adaptable. Su llamada es una de las más profundas y características del Neotrópico.
Notas sobre conservación (actualizado a 2025)
-
La fragmentación del hábitat, la cacería local y las enfermedades zoonóticas (como el brote de VSRp en A. seniculus) representan amenazas crecientes.
-
Las poblaciones de Alouatta suelen ser más resistentes a la fragmentación que otros primates neotropicales, debido a su dieta folívora, pero pueden colapsar en fragmentos muy pequeños.
-
La pérdida de conectividad es especialmente grave para A. palliata en Panamá y Costa Rica.
-
El cambio climático afecta la fenología de las plantas clave en la dieta.
Recomendaciones de manejo moderno:
-
protección de corredores ribereños,
-
restauración forestal multifuncional,
-
monitoreo acústico para estimación poblacional,
-
estudios genómicos para resolver complejos de especies.
TABLA DE COMPARACIÓN TAXONÓMICA (1894 vs. 2025)
Género Alouatta — evolución histórica de la nomenclatura
| Nombre según Forbes (1894) | Sinónimos citados en 1894 | Especie válida (2025) | Región principal (2025) | Comentarios modernos |
|---|---|---|---|---|
| Mycetes (género) | Stentor, Mycetes, Alouatta | Alouatta (único género de Alouattinae) | Neotrópico | Forbes aún usaba Mycetes; hoy está completamente en desuso. |
| Alouatta seniculus (Red Howler) | Simia seniculus, Stentor ursina, Mycetes seniculus, M. stramineus, M. chrysurus, M. auratus, M. laniger, etc. | Alouatta seniculus (complejo) | Amazonia, Orinoquía, Andes secos | Es un complejo de especies aún en revisión molecular. Variación amplia de color. |
| Alouatta nigra (Black Howler) | Stentor caraya, Mycetes niger, M. barbatus, M. caraya | Alouatta caraya | Sur de Brasil, Paraguay, Bolivia, norte de Argentina | Nombre moderno universal: A. caraya. Dimorfismo sexual marcado. |
| Alouatta beelzebul (Yellow-handed Howler) | Simia beelzebul, Mycetes rufimanus, M. discolor, Colobus chrysurus (dudoso) | Alouatta belzebul | Amazonia oriental (Pará–Maranhão) | Persisten variantes regionales discutidas; especie vulnerable. |
| Alouatta ursina (Brown Howler) | Stentor ursina, S. flavicauda, M. fuscus, M. bicolor, M. ursinus | Alouatta guariba / Alouatta discolor | Bosque Atlántico del sureste de Brasil | La taxonomía moderna separa A. guariba vs. A. discolor. La forma “ursina” no es válida. |
| Alouatta villosa (Guatemalan Howler) | Mycetes villosus | Alouatta pigra | Belice, Guatemala, Tabasco–Campeche–QR (México) | Especie grande, negra. Catalogada como En Peligro (EN). |
| Alouatta palliata (Mantled Howler) | Mycetes palliatus | Alouatta palliata | México–Panamá–Colombia–Ecuador | Varias subespecies: A. p. palliata, A. p. aequatorialis, A. p. mexicana. En Panamá: A. p. palliata (occidente) y A. p. aequatorialis (Darién). |
Resumen interpretativo
1. Cambios principales desde 1894
-
El género Mycetes quedó totalmente reemplazado por Alouatta.
-
Se aclaró la verdadera identidad de A. villosa → hoy A. pigra.
-
Se corrigió la identificación del “aullador pardo” → hoy parte del complejo A. guariba/discolor.
-
A. nigra no es un nombre válido → corresponde al moderno A. caraya.
-
A. belzebul mantiene su nombre moderno, con mínima variación.
2. Cambios en límites geográficos
Forbes trabajaba con mapas y relatos de viajeros; hoy sabemos que:
-
A. palliata no llega al sur de Colombia.
-
A. pigra nunca habitó Honduras occidental más allá de zonas adyacentes a Guatemala.
-
A. seniculus tiene estructura poblacional compleja por amazonización y refugios pleistocénicos.
3. Cambios conceptuales
-
Se abandonaron ideas como “baja inteligencia” o “disposición hosca” —hoy reconocidas como sesgos coloniales del siglo XIX.
-
Se comprendió la evolución del hioides resonante como innovación adaptativa.
-
Se actualizaron criterios de especie con genética mitocondrial y genómica (Cortez-Ortiz, Ruiz-García, Byrne, etc.).
REFERENCIA
Forbes, Henry O. 1894. A Hand-Book to the Primates. Allen’s Naturalist’s Library. Edited by R. Bowdler Sharpe. Vol. I. London: W. H. Allen & Co., Limited, 13 Waterloo Place, S.W.